|
本文来自微信公众号:自然系列,作者:Nature Portfolio,原文作者:Diana Kwon,原文标题:《心理压力如何在分子层面加速你的衰老?》,题图来自:AI生成 衰老生物学中可能存在一个悖论:随着人类年龄增长,整体新陈代谢通常会变慢,肌肉质量减少,热量消耗也大幅下降。然而,老年人的某些细胞表现恰恰相反??它们消耗的能量比年轻时还要多。 这些潜在“能耗大户”是衰老细胞,即那些已经停止分裂、不再执行原有重要功能的老化细胞。纽约哥伦比亚大学的心理生物学家Martin Picard说,由于它们看起来闲着没事,生物学家曾认为,这些宛如僵尸的衰老细胞的能量消耗应低于仍在复制的年轻细胞。 但2022年,Picard的一位前研究生Gabriel Sturm细致观察了培养皿中人类皮肤细胞的整个生命周期[1](研究结果尚未全部发表),发现这些停止分裂的衰老细胞代谢速率竟然约为年轻细胞的两倍。 在Picard和同事看来,这种能量使用上的不匹配并不矛盾:衰老细胞会积累一些高能耗的损伤如DNA改变,并激活促炎信号。这与机体在衰老过程中总体能量消耗较低之间的对应关系尚不清楚,但研究人员提出一种假设:这种内在的能量紧张可能正是许多衰老负面效应的重要驱动因素,而大脑则可能在其中扮演着关键的调控角色[2]。他们认为,当某些细胞变老并对能量的需求增加时,大脑会作出响应,从其他生理系统中“抽调”资源来补偿,从而导致诸如头发变白、肌肉流失等肉眼可见的衰老特征(见“能量管理与衰老”)。 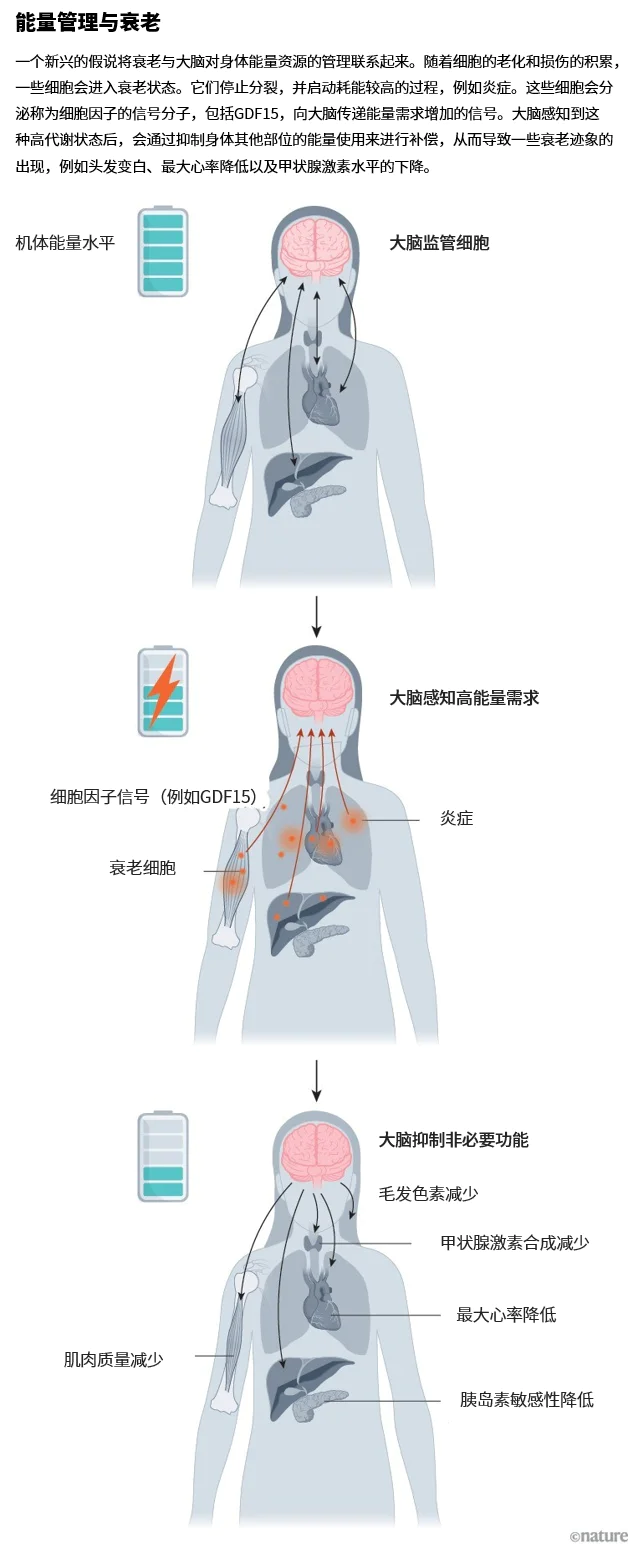
来源:Ref. 2 Picard及其同事将这一观点称为“大脑?身体能量节约模型”。尽管这一假说的许多部分尚未验证,但科学家们正在努力揭示大脑如何具体调控与衰老相关的各类过程,例如细胞衰老、炎症以及端粒缩短(端粒是位于染色体末端的重复DNA序列,具有保护染色体的功能)。一些研究人员指出,这项研究也开始揭示心理压力如何在分子层面加速衰老的机制。明尼苏达大学的生物学家Alessandro Bartolomucci表示,这一观点曾一度被视为衰老研究的边缘理论,但如今正逐渐进入主流。“科学会证明自己,这个领域不能忽视这个看法。” 磨损与消耗 一开始指向大脑在衰老中扮演角色的部分证据,来自揭示心理压力对单个细胞影响的研究。 21世纪初,当时在加州大学旧金山分校(UCSF)从事博士后研究的Elissa Epel与同事展开研究,试图探究慢性压力是否会在细胞层面留下印记。Epel回忆说,当时关于长期压力对健康造成负面影响的研究文献已经“非常让人印象深刻”,她现在是UCSF的健康心理学家,“但我们对这些影响在细胞层面发生的变化知之甚少。” 因此,研究团队决定从端粒长度入手。端粒会随着生物体生命周期逐渐缩短,而这一过程已被证明与细胞衰老及其他形式的年龄相关变化密切相关。 研究团队招募了58名健康女性参与实验:其中19人育有健康子女,另外39人有一个患慢性病的孩子。研究人员推测,后者相比前者在日常生活中承受的压力更高[3]。Epel团队发现,那些长期照顾患病子女的母亲,其端粒明显比其他人更短,且端粒长度与承担照护工作的年数负相关。亚利桑那州立大学生物学家Noah Snyder-Mackler指出,这些发现表明长期压力暴露可能引发与衰老密切相关的分子层面改变。 此后,研究人员也在其他类型的压力暴露人群中发现了端粒缩短的证据,例如童年逆境经历者以及长期职业疲劳者[4]。尽管在端粒长度方面的研究结果存在不一致,但科学界已积累了大量证据,将心理压力与其他分子层面的衰老标志联系起来。 例如,北卡罗来纳大学教堂山分校的医师科学家Anthony Zannas和团队通过对大规模人群队列进行研究,发现长期高强度的压力暴露与表观遗传组的加速衰老特征相关。表观遗传组是指基因组化学修饰模式(如DNA甲基化),参与调控基因表达。这些变化可能由皮质醇等应激激素介导。Zannas团队发现,在女性群体中,较高水平的皮质醇与DNA甲基化水平降低相关,同时伴随肿瘤坏死因子(TNF)基因表达的上调??TNF是一种与炎症反应相关的信号分子[5]。 有人在动物模型中研究了这些过程。尽管动物模型存在局限性??例如人类的压力来源更为复杂,涉及多种社会、心理和生物因素??但这些动物研究提供了在人类实验中难以获得的机制性见解。Bartolomucci及其团队发现,啮齿动物在长期社会性压力下(如遭受优势动物的攻击行为)会损害心脏健康并导致寿命缩短[6]。他们还发现,这类逆境经历与多种与衰老相关的分子变化有关,例如与衰老相关信号的积聚。 例如,在2024年的一项雄性小鼠研究中,Bartolomucci团队发现,在生命早期的一段相对短暂时期内经历社会性压力,会导致小鼠大脑、脂肪组织和免疫细胞中一种细胞衰老关键标志物p16的表达水平升高[7]。这些变化只出现在经历社会性压力的小鼠中??那些接受了另一种压力形式(每天被限制在小管中3小时、持续一个月)的动物,并未表现出p16的累积。 Snyder-Mackler的团队则在恒河猴中开展了类似研究。这种动物天生会在群体中形成社会等级,新成员通常社会地位较低。通过依次将猕猴引入群体,研究人员能够观察社会地位对其健康的影响。他们发现,社会性压力可通过多种机制影响免疫系统。在社会等级较低的恒河猴中,其免疫细胞中与炎症相关基因的表达显著增加[8]。这些影响至少在一定程度上是可逆的:当恒河猴的社会地位调整后,其免疫细胞中的基因表达模式也会随之改变,符合新的社会地位。Snyder-Mackler指出,他们尚未研究这些分子变化如何影响寿命??恒河猴的寿命可长达约30年,因此很难研究这方面。 Epel总结道:“我们现在已经拥有一整套由全球多方共同努力建立起来的、稳固的研究发现,慢性压力会影响细胞层面所有的衰老标志。” 衰老总指挥 这些发现揭示了与大脑的明确关联,人们已经知道大脑调控着机体对心理和生理压力的反应。但迄今为止,学界尚无统一的理论模型,将这些发现整合成关于大脑如何协调这些过程的完整假说。 Picard及其团队认为,他们提出的“大脑-身体能量节约模型”可能为此提供理论框架,用以解释压力效应如何从大脑传导至全身。研究团队甚至锁定了一个可能在衰老过程中起关键作用的分子:生长分化因子15(GDF15)。 GDF15是一种细胞因子(即细胞信使),被部分研究者视为人类衰老的关键调控因子。该分子与多种衰老相关过程存在关联,包括细胞衰老、线粒体(细胞的能量工厂)功能障碍,以及阿尔茨海默病等年龄相关疾病[9]。在各类慢性身心疾病中,GDF15水平均会升高,且与妊娠、癌症等状况引发的恶心、食欲减退密切相关。虽然GDF15由多种器官分泌,但其受体仅存在于大脑[10-12]。这些特性使研究者推测:GDF15可能负责向大脑传递细胞应激信号。 Picard团队在今年发布的预印本研究中揭示,人体血液和唾液中的GDF15水平会因心理压力刺激而升高[13]。这一发现表明,“大脑-身体能量节约模型”可能至少揭示了心理压力促进衰老的一条作用通路(Picard特别指出,心理压力本身也是一个高能耗的生理过程)。 Bartolomucci指出,“大脑-身体能量节约模型”具有多重吸引力,其一在于整合了多种衰老相关现象。他补充说,虽然单个分子不太可能成为衰老这种复杂过程的唯一驱动因素,但GDF15确实是“极有趣的一个分子”,可能在衰老机制中发挥重要作用。“这些发现在特定衰老过程中如何发展,我想还有待观察。”他说。 当前,研究人员正积极探寻药物干预和行为疗法,以期延长人类健康寿命。例如,Epel团队正在研究运动等干预措施如何缓解压力对衰老的影响。部分研究表明,体育锻炼可能通过多种途径延长寿命,包括缓解长期压力人群的端粒缩短问题[14]。 这项研究对当前抗衰老药物的临床试验也可能产生重要的影响??许多研究者强调,在人体测试这些疗法时,有必要将压力作为关键变量纳入考量。 目前仍有许多未解之谜亟待探索。未来研究的重要方向包括:解析压力来源类型与作用时机对衰老进程的影响机制,以及不同年龄相关生物学变化如何并在何时叠加。“我们总期待简单的答案,希望用表观遗传时钟或端粒长度等统一指标衡量衰老。” Epel说,“但生物学不是那么简单的。” 参考文献: 1.Sturm, G. et al. Preprint at bioRxiv https://doi.org/10.1101/2022.05.10.491392 (2023). 2.Shaulson, E. D., Cohen, A. A. & Picard, M. Nature Aging 4, 1354?1371 (2024). 3.Epel, E. S. et al. Proc. Natl Acad. Sci. USA 101, 17312?17315 (2004). 4.Rentscher, K. E., Carroll, J. E. & Mitchell, C. Annu. Rev. Public Health 41, 223?245 (2020). 5.Palma-Gudiel, H. et al. Brain Behav. Immun. 92, 49?56 (2021). 6.Razzoli, M. et al. Aging Cell 17, e12778 (2018). 7.Lyons, C. E. et al. Nature Aging 5, 48?64 (2025). 8.Snyder-Mackler, N. et al. Science 354, 1041?1045 (2016). 9.Chiariello, A. et al. Front. Aging Neurosci. 14, 1058665 (2022). 10.Yang, L. et al. Nature Med. 23, 1158?1166 (2017). 11.Hsu, J.-Y. et al. Nature 550, 255?259 (2017). 12.Mullican, S. E. et al. Nature Med.23, 1150?1157 (2017). 13.Huang, Q. et al. Preprint at bioRxiv https://doi.org/10.1101/2024.04.19.590241 (2025). 14.Puterman, E. et al. Psychoneuroendrocrinology 98, 245?252 (2018). (原文以How your brain controls ageing ? and why zombie cells could be key标题发表在2025年6月17日《自然》的新闻特写版块上。本文由施普林格?自然上海办公室负责翻译。中文内容仅供参考,一切内容以英文原版为准。) 本文来自微信公众号:自然系列,作者:Nature Portfolio,原文作者:Diana Kwon
|







